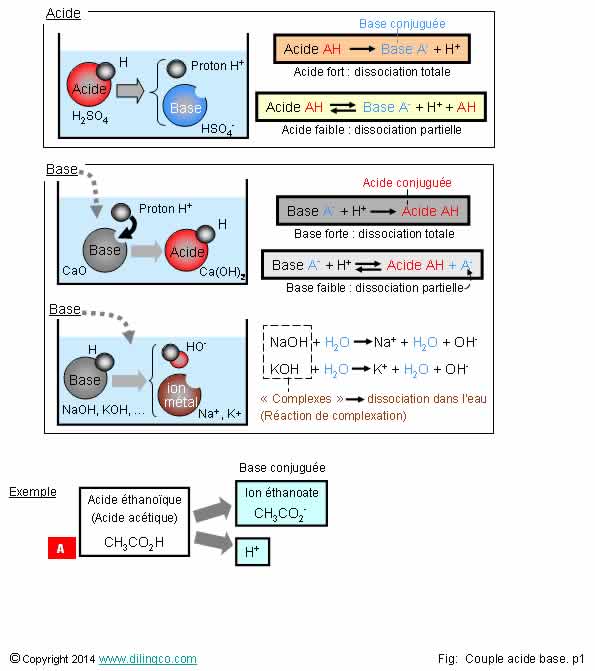
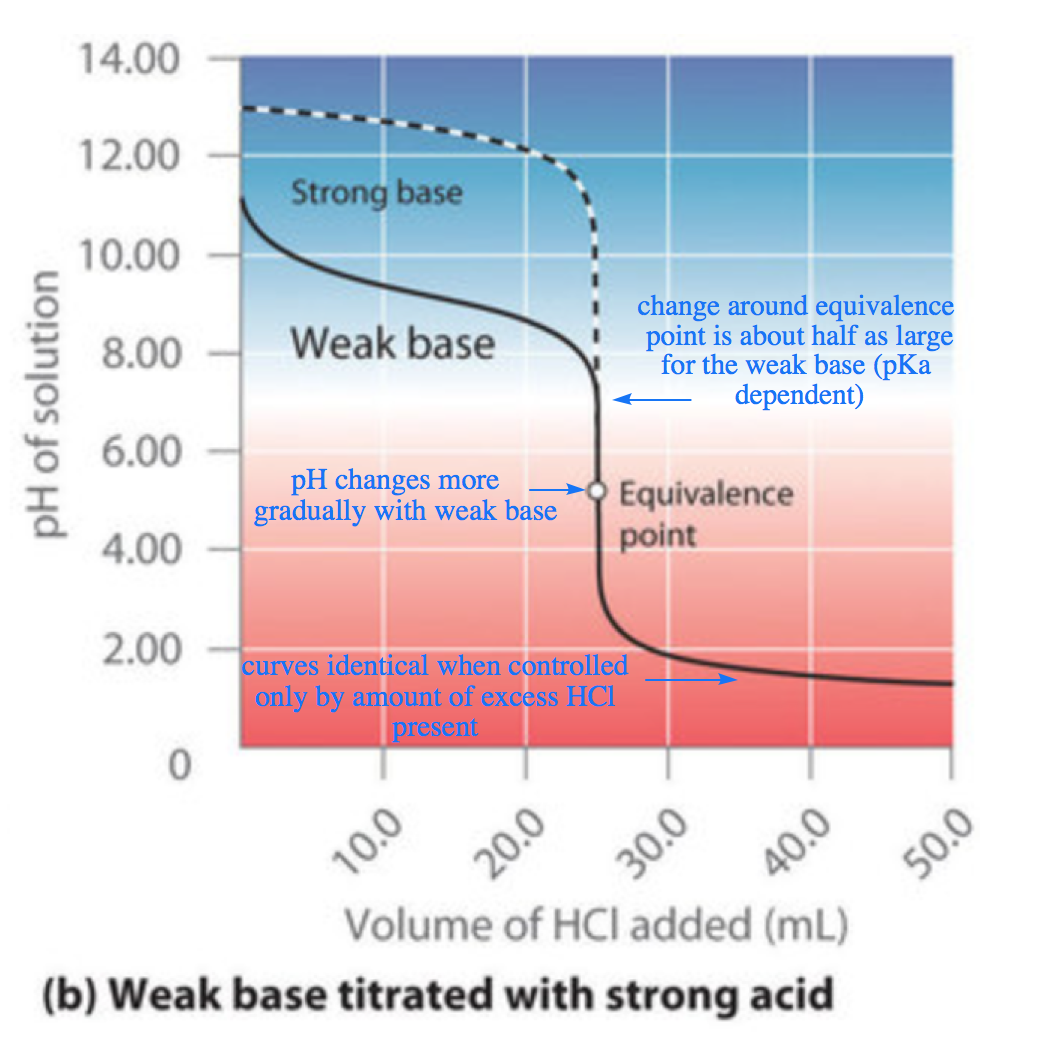
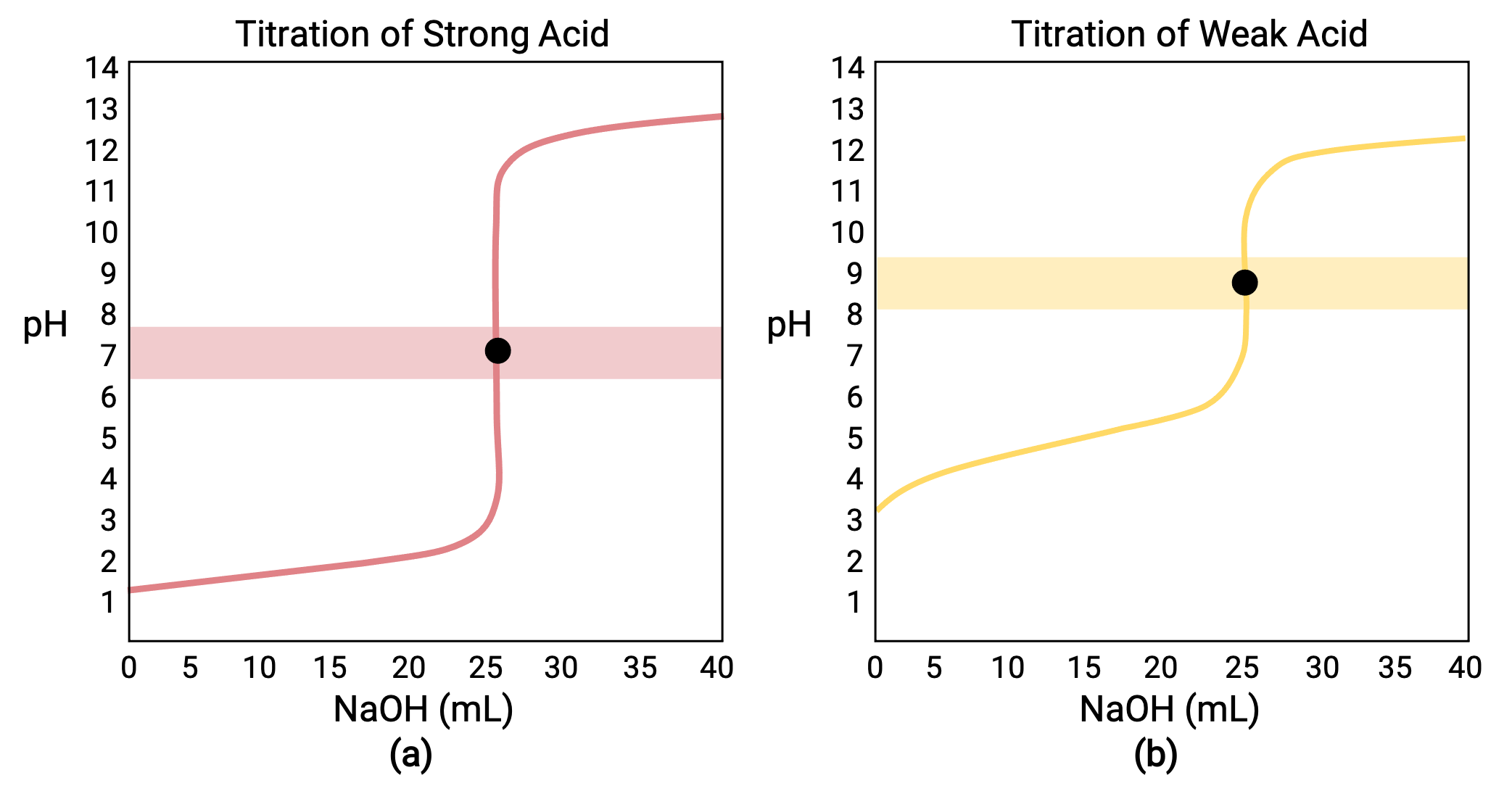
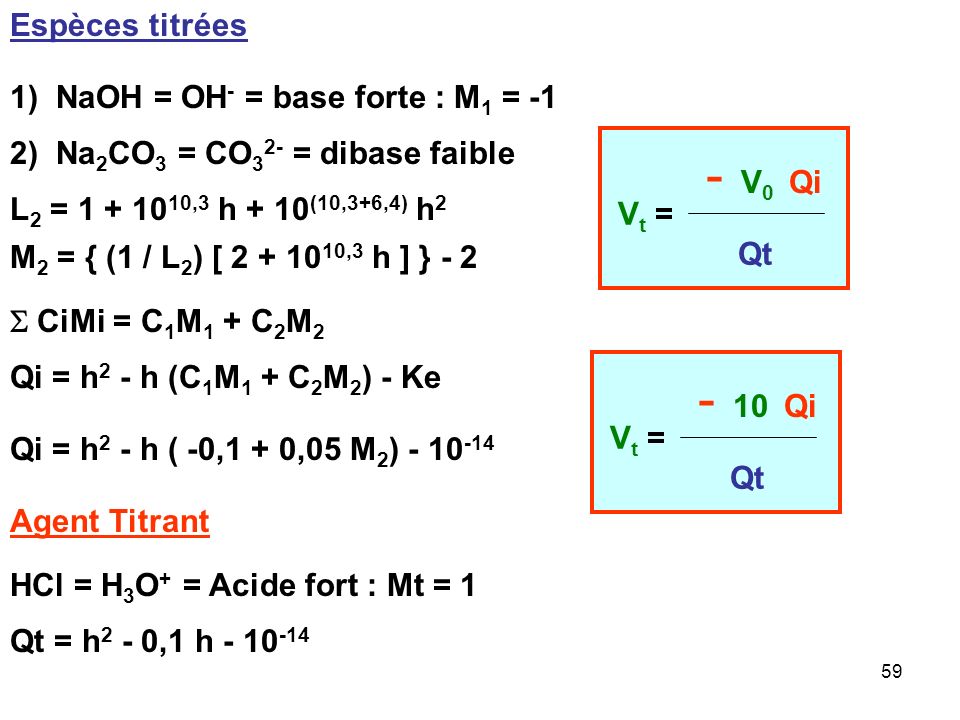
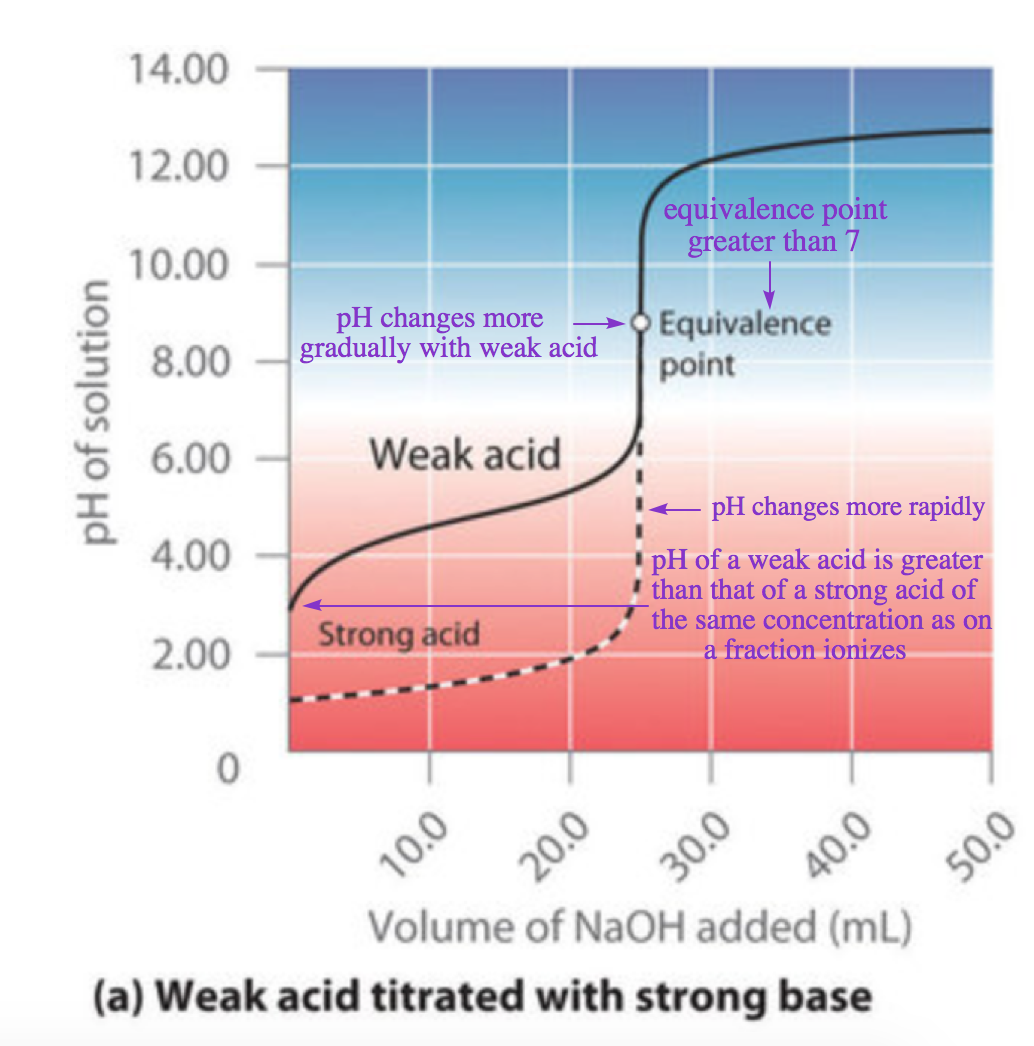
Acide-base, Réaction De Neutralisation D'acide Chlorhydrique Et Hydroxyde De Sodium Types De Réactions Chimiques, Partie De 7 Illustration de Vecteur - Illustration du acide, atome: 94216277

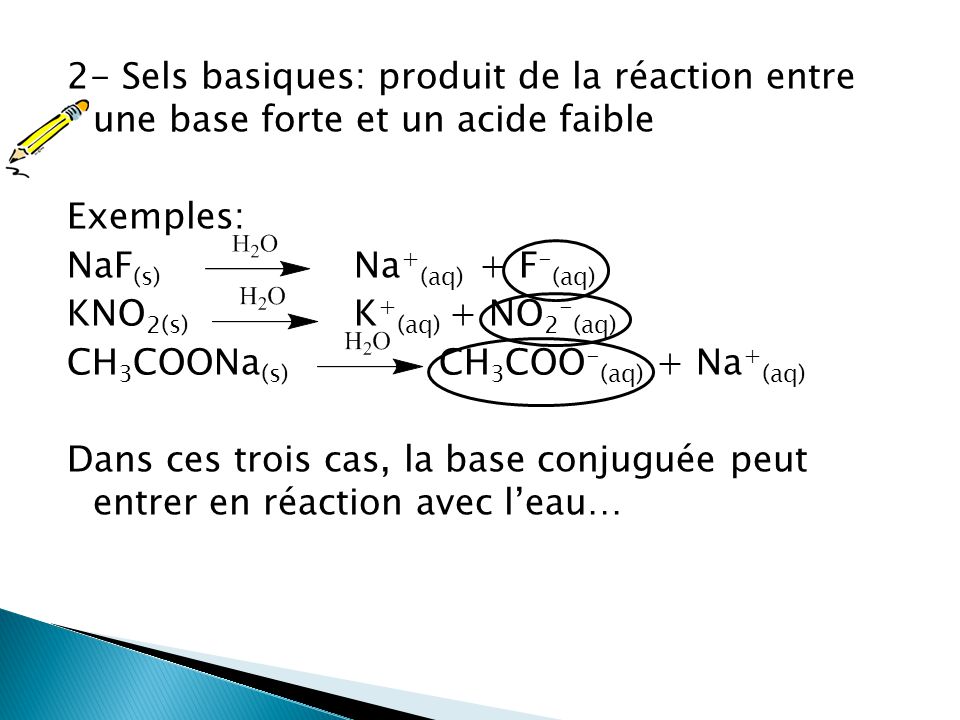
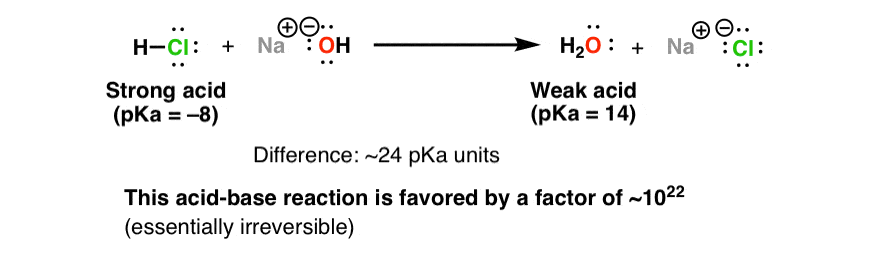
G) Sels Dans le chapitre 1, Acide + Base Sel + Eau HCl(aq) + NaOH(aq) NaCl(aq) + H2O Les sels sont des électrolytes forts qui se dissocient entièrement. - ppt video online télécharger

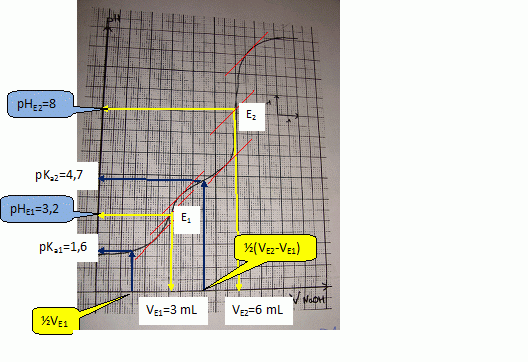
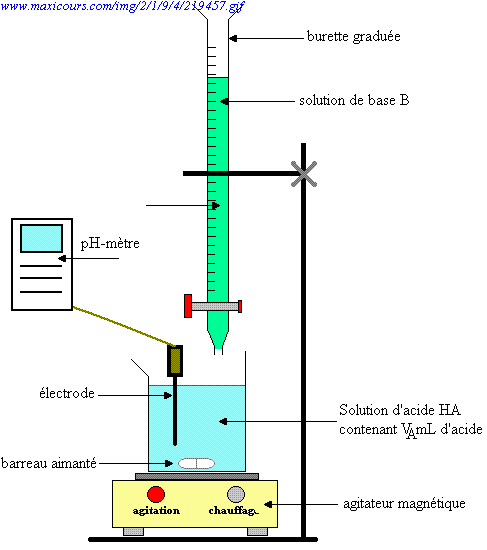
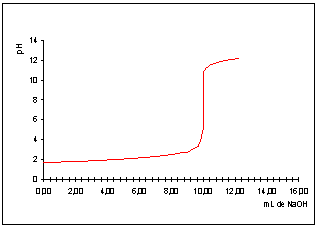
SOLVED: Question 4 (1 point) You will determine the concentration of an unknown diprotic acid using your standardized base: The chemical equation for this reaction can be expressed as: Vous determinez la